Tugas Pokok Bahasan 2 Baterai dan Sistem Penyimpanan Energi
- Dapatkan link
- X
- Aplikasi Lainnya
Nama : Sandrina Aprianti
NIM : 1106220006
Kelas : TR-46-GAB
Mata Kuliah : Baterai dan Sistem Penyimpan Energi
LATIHAN PERTEMUAN 2 BATERAI DAN SIMTEM PENYIMPANAN ENERGI
1. Konsep Energi Gibbs dan Persamaan Nernst dalam Baterai
a. Energi Gibbs ()
Energi Gibbs (ΔG) menunjukkan energi bebas yang tersedia untuk melakukan kerja dalam suatu reaksi kimia. Untuk reaksi redoks dalam baterai, hubungan antara energi Gibbs dan tegangan sel diberikan oleh:
Dimana:
- = perubahan energi bebas Gibbs (Joule/mol)
- = jumlah mol elektron yang terlibat
- = konstanta Faraday ( C/mol)
- = tegangan sel (Volt)
Jika ΔG<0, maka reaksi spontan, sehingga baterai dapat menghasilkan listrik (discharge). Sebaliknya, jika ΔG>0, maka reaksi tidak spontan dan memerlukan energi eksternal untuk berlangsung (charging).
b. Persamaan Nernst dan Tegangan Baterai
Persamaan Nernst digunakan untuk menghitung tegangan sel elektrokimia pada kondisi non-standar:
Dimana:
- = tegangan sel pada kondisi tertentu (V)
- = tegangan sel standar (V)
- = konstanta gas universal ( J/mol·K)
- = suhu dalam Kelvin (K)
- = jumlah elektron yang terlibat dalam reaksi
- = konstanta Faraday
- = hasil bagi reaksi, yaitu rasio konsentrasi produk terhadap reaktan
Hubungan dengan Tegangan Baterai:
- Saat baterai discharge, konsentrasi asam sulfat () menurun, menyebabkan meningkat. Akibatnya, tegangan baterai menurun seiring pemakaian.
- Saat baterai charging, elektrolit diregenerasi, sehingga konsentrasi meningkat dan menurun, sehingga tegangan baterai kembali meningkat.
- Jika baterai terlalu lama digunakan tanpa diisi ulang, tegangan baterai turun drastis hingga tidak dapat menghasilkan arus listrik yang cukup.
Dalam baterai timbal-asam, konsentrasi asam sulfat () mempengaruhi tegangan baterai.
- Saat discharge, konsentrasi berkurang, sehingga meningkat dan tegangan baterai menurun.
- Saat charging, konsentrasi meningkat, sehingga tegangan baterai naik.
Interpretasi Fisik:
- Jika ΔG<0 (negatif),
reaksi berlangsung spontan. Ini berarti baterai dapat
menghasilkan listrik secara alami dalam proses discharge (pelepasan
daya).
- Jika ΔG>0 (positif),
reaksi tidak spontan dan memerlukan energi eksternal. Ini terjadi
saat charging (pengisian daya), di mana energi listrik
dari luar digunakan untuk membalikkan reaksi redoks dalam baterai.
Sebagai contoh, dalam baterai timbal-asam (Pb-acid battery), selama discharge, reaksi redoks berjalan spontan, melepaskan energi yang digunakan untuk menggerakkan arus listrik. Sebaliknya, saat charging, energi listrik dari sumber daya eksternal digunakan untuk membalikkan reaksi redoks, sehingga baterai dapat digunakan kembali.
2. Reaksi Redoks pada Baterai Timbal-Asam
Baterai timbal-asam (-acid battery) menggunakan asam sulfat () sebagai elektrolit, dengan elektroda timbal () dan timbal dioksida ().
a. Proses Discharge (Pelepasan Daya)
Ketika baterai digunakan untuk mengalirkan listrik, terjadi reaksi redoks sebagai berikut:
Anoda (oksidasi, elektroda negatif):
P b + S O 4 2 − → P b S O 4 + 2 e − Timbal () teroksidasi menjadi timbal sulfat (), melepaskan elektron ke rangkaian eksternal.
Katoda (reduksi, elektroda positif):
P b O 2 + 4 H + + S O 4 2 − + 2 e − → P b S O 4 + 2 H 2 O Timbal dioksida () direduksi menjadi timbal sulfat (), sambil mengonsumsi ion hidrogen () dari elektrolit.
Reaksi total (discharge):
P b + P b O 2 + 2 H 2 S O 4 → 2 P b S O 4 + 2 H 2 O P Asam sulfat () berkurang, menyebabkan penurunan tegangan baterai.
Arah Pergerakan Partikel Selama Discharge
- Elektron () mengalir dari anoda (Pb) ke katoda (PbO₂) melalui rangkaian eksternal.
- Arus listrik (konvensional) mengalir dari katoda ke anoda.
- Kation () bergerak menuju katoda, sementara anion () bergerak menuju anoda.
b. Proses Charging (Pengisian Daya)
Ketika baterai diisi ulang, reaksi berjalan terbalik:
Anoda (reduksi, elektroda positif saat charging):
Timbal sulfat () direduksi kembali menjadi timbal (), dan ion sulfat kembali ke larutan.
Katoda (oksidasi, elektroda negatif saat charging):
P b S O 4 + 2 H 2 O → P b O 2 + 4 H + + S O 4 2 − + 2 e − Timbal sulfat () diubah kembali menjadi timbal dioksida (), dan ion hidrogen dilepaskan ke larutan.
Reaksi total (charging):
Asam sulfat () terbentuk kembali, meningkatkan densitas elektrolit dan tegangan baterai.
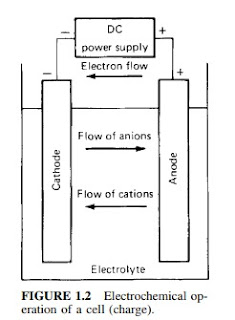
Arah Pergerakan Partikel Selama Charging
- Elektron dipaksa masuk ke anoda dari sumber daya eksternal.
- Arus listrik mengalir dari anoda ke katoda melalui rangkaian eksternal.
- Kation () bergerak menuju katoda, sementara anion () bergerak menuju anoda.
Kesimpulan
- Energi Gibbs menentukan spontanitas reaksi baterai, dengan menentukan apakah reaksi dapat menghasilkan listrik atau membutuhkan energi eksternal.
- Persamaan Nernst menghitung tegangan baterai berdasarkan konsentrasi elektrolit.
- Reaksi redoks baterai timbal-asam terjadi secara reversibel antara discharge dan charging.
- Dapatkan link
- X
- Aplikasi Lainnya





Komentar
Posting Komentar